引言
合成氨的发明,是革命性的人工固氮技术。它结束了人类完全依靠天然氮肥的历史,给人类发展带来了福音。今天就让我们一起深入学习“伟大的合成氨”以及合成氨发明者——弗里茨·哈伯(Fritz Haber,1868~1934)背后的故事。
伟大的合成氨
一 、合成氨兴起的背景
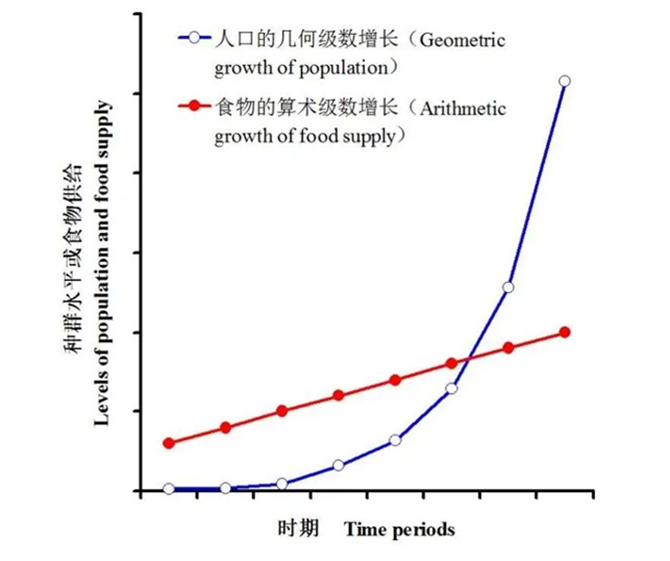
马尔萨斯人口论:人口增长受到了资源限制
1798年,著名的政治经济学家马尔萨斯指出:“人口以几何比率增加,生活资料以算术比率增长,人口增长有经常超过生活资料增长的趋势”。
19 世纪初:人们在秘鲁海岛附近的小岛上,发现了数以百万吨计的鸟粪,鸟粪中因含有丰富的有机质和氮磷化合物,属于上好的作物肥料,引发各国争抢热潮——仅1869 年,就有55万余吨的鸟粪被开采。然而由于过度开采,这些鸟粪被很快耗尽。
19 世纪70年代:人们在智利发现了一种富含氮的硝酸盐矿石,氮肥紧缺的危机得以暂时缓解。不过好景不长,经过数十年的开采,智利硝石也出现了即将耗尽的迹象。
19世纪末到20世纪初:德国工业发展迅速,人口也开始快速增长,对于氮肥的需求与日俱增。智利硝石的日益枯竭以及对于爆发战争的担忧——如果发生战争,德国海上硝石运输线被英国切断,他们将面临缺少粮食和弹药的困境。德国意识到必须找到人工合成氨的方法。
这些问题始终难以解决,直到犹太人弗里茨 · 哈伯的出现。
二 、合成氨的原理

合成氨反应式
看起来非常简单的方程式,但是破坏三键是一件很困难的事情。
在自然界中,只有两种途径可以破坏氮气的三键——第一个就是闪电,闪电短时间内释放的巨大能量能够让一些氮气分子分解成氮的自由基,这些自由基又很快地和氧气发生反应生成氮氧化物;第二种就是生物固氮,最有名的就是根瘤菌,但是根瘤菌固氮的速度不能满足快速增长的人口。
那Haber-Bosch工艺法是如何实现人工固氮呢?
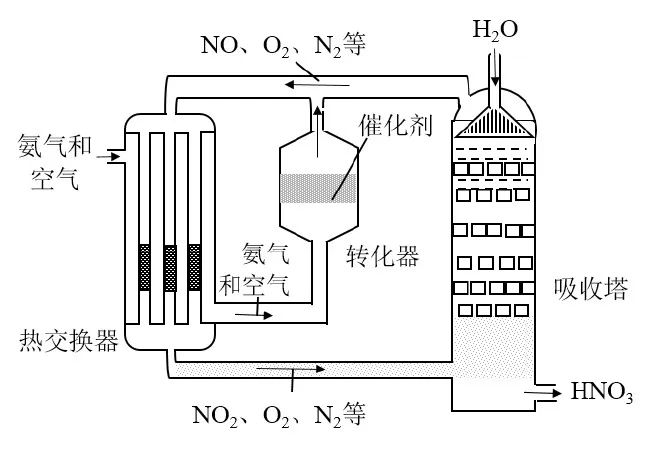
Haber-Bosch工艺法示意图
1. 如何获得纯净的氢气和氮气:
在炽热的焦炭上方吹入水蒸汽,可以获得近1:1的一氧化碳和氢气的混合气体,其中的一氧化碳在催化剂的作用下,进一步与水蒸汽反应,得到二氧化碳和氢气。然后将混合气体在一定压强下溶于水,使二氧化碳被吸收,制得了较纯净的氢气。同样将水蒸汽与适量的空气混合通过红热的炭,空气中的氧气与碳便生成一氧化碳和二氧化碳而被吸收除掉,从而得到了所需要的氮气。
2.最佳反应条件:
哈伯认为合成氨反应是一个可逆反应,并且提出增加反应的压力和降低反应的温度,有利于氨平衡时浓度的升高。那最佳反应条件是什么呢?
①温度:600℃
②压力:200MPa
③催化剂:锇,触媒催化剂
3. 循环压缩工艺:
哈伯认为若能使反应气体在高压下循环加工,并从这个循环中不断地把反应生成的氨分离出来,可以提高氨的转化率。

工业合成氨微观示意图
氮分子在催化剂表面上进行化学吸附,使氮原子间的化学键减弱,接着是化学吸附的氢原子不断地跟表面上的氮分子作用,在催化剂表面上逐步生成—NH、—NH2和NH3,最后氨分子在表面上脱析而生成气态的氨。
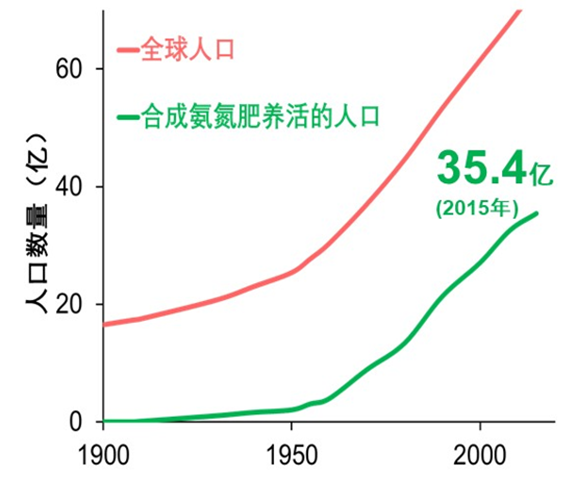
氮肥对全球人口增长贡献巨大
经过一百年多年的发展,合成氨工业取得了巨大的进步。
单套生产装置的规模已由当初的日产合成氨5吨发展到目前的2200吨;反应压力已由 100 MPa 降到10~15 MPa,能耗已从 780 亿焦降到 272 亿焦。已接近理论的能耗201亿焦。
目前,科学家利用可再生电力、光催化还原、SWAP(Samarium-Water Ammonia Production)等新方式进行合成氨反应。
01可再生电力
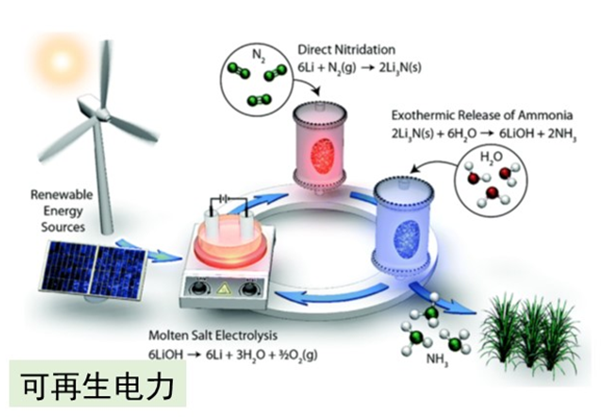
利用可再生电力生产氨流程示意图
由电力驱动,可以利用风能和太阳能供应,从水中提取氢气的电解过程。这种方法可以大大降低温室气体排放量。
02光催化氮还原

光催化氮还原流程示意图
利用太阳能激发光催化剂中的电子转移,来实现室温和压力下将水和N2转化为NH3。因为它不再需要直接裂解氮气的三键的缔合途径,从而大大减少了所需的能量输入。
03SWAP
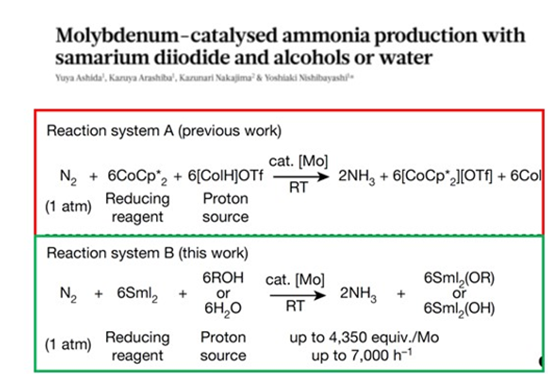
SWAP和原始方法的比较
SWAP(Samarium-Water Ammonia Production)是指将醇类或者水作为质子来源与二碘化钐(SmI2)联合使用对氮气进行固定的方法。
利用钼基催化剂重现固氮酶行为,在反应中水(醇)提供质子,钐提供电子。这种方法可以借助钼复合物催化剂的作用在正常环境条件下实现氮气的催化还原。
SWAP产氨速度为Haber-Bosch工艺的300-500倍。
四、合成氨用于战争
然而,自合成氨工艺诞生之后,并没有第一时间应用于农业,而是运用在战争上。
德国有了哈伯合成氨法的工艺。有了氨气,合成各种硝酸和硝酸盐就不再困难。
从1911年到1913年短短的两年内,制造出3500吨烈性炸药TNT。到1913年的第一次世界大战时,哈伯已为德国建成了无数个大大小小的合成氨工厂,为侵略者制造了数百万吨炸药,因而导致并蔓延了这场祸及全球的世界大战。
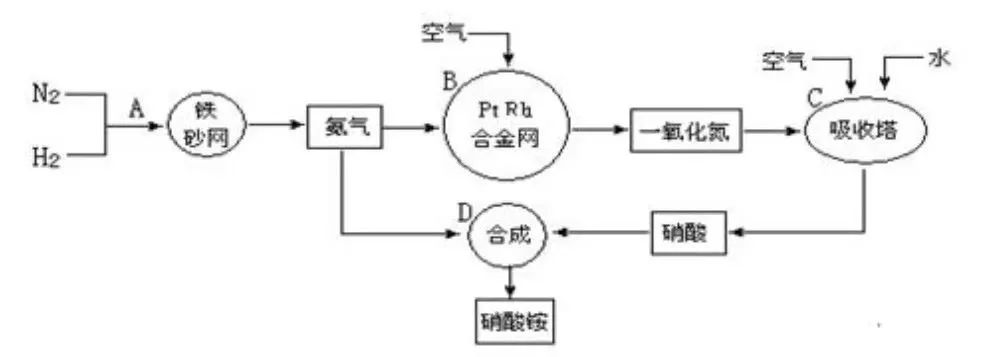
合成氨与硝酸工业的关系
在当时,德国人顾不上拿这些氨气制作化肥。随着战争日益残酷,英国对德国的海上封锁日益收紧,德国人不缺打仗的炮弹,但却陷入了可怕的粮荒。
1917年冬天,德国平民已经吃不上麦子,改吃牲口饲料芜菁,那一年的冬天也被后世称为“芜菁之冬”。
1918年秋天,粮荒在德国更加严重,连水兵都没得吃了,于是他们发动了暴动,看似不可一世的德意志第二帝国,也轰然倒塌。
哈伯法合成氨应用于军事,就这样以悲剧告终!
弗里茨·哈伯的一生
一、化学天才
1868年12月9日弗里茨·哈伯出生于德国东普鲁士布雷斯劳(现属波兰)一个犹太人富商家庭。
他在读书期间就显现出巨大的化学天赋,23岁那年,德国皇家科学院破格授予他化学博士学位。
1904年,哈伯开始进行合成氨的试验。此前已有无数科学家从18世纪中叶就开始这一努力,历经一个半世纪,仍研究未果。
1906年,哈伯在600℃高温、200MPa高压条件下,用锇作催化剂,以氢气和大气中的氮为原料,成功发明氨平衡浓度为6%~8%的合成氨反应。1909年,他又用原料气循环使用的方法,成功地解决了氨产率不高的问题。
1913年9月,BASF 的第一座合成氨工厂在奥堡建成投产了。
哈伯的发明震动了全球化学界,并产生划时代效应。他的发明使大气中的氮变成生产氮肥的、永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱。哈伯因此被称作解救世界粮食危机的化学天才。
二 、丧心病狂的毒气弹魔鬼
哈伯建成氨工厂同年,一战爆发。作为一个狂热的民族主义者,哈伯完全效忠于德皇,为了达成速战速决的目标,于是走上了毒气弹的研制和使用的道路。
1914年9月,哈伯向德军参谋本部提出了一条灭绝人性的建议:用他研制的化学武器打开缺口。德军在哈伯的指导下很快建立了世界第一支毒气部队。
1915年4月,哈伯亲临前线指挥毒气弹的施放。大量的钢瓶氯气飘向联军阵地。这场化学战首开了人类战争史上将毒气弹用于实战的先例。联军1.5万人中毒,其中5000人死亡。
哈伯的行为遭到无数仁人志士的指责。
他妻子克拉克·哈伯的反对最为强烈。但此时的哈伯已丧心病狂,完全被所谓的民族主义蛊惑,听不进去任何劝告。他妻子万念俱灰,愤而自杀。
1915年12月,哈伯指挥他的毒气部队对伊普尔地区的英军施放毒剂,造成英军1000余人中毒;1917年,他又指导德军对英军进行首次芥子气攻击,10天内使英军1.4万人中毒。
三 、迟到的忏悔
毒气弹在战争中一次又一次惨无人道的灾难性杀伤,使哈伯越来越受到世界爱好和平的人民的强烈谴责。在这种谴责下,哈伯终于开始反省自己的滔天大罪,内心十分痛苦。1917年,他毅然辞去他在化学兵工厂和部队的所有职务,以向那些在毒气弹中痛苦死去或终身残废的人谢罪。(整个一战中,有130万人受到化学战的伤害,其中有9万人死亡,幸存者中约有60%的人因伤残离开军队。这些都与哈伯研制化学武器、指挥化学战有关。)
1919年,瑞典科学院考虑到哈伯发明的合成氨对全球经济巨大的推动作用,决定给哈伯颁发1918年唯一的诺贝尔化学奖。消息传来,全球哗然。一些科学家指责这一决定玷污了科学界。但也有一些科学家认为,科学总是受制于政治,科学史上许多发明既可用来造福人类,也可用于毁灭人类文明;哈伯发明合成氨,可以将功抵过。
面对接踵而来的掌声与唾骂,哈伯平静地说:“我是罪人,无权申辩什么,我能做的就是尽力弥补我的罪行。”
1933年,哈伯被迫离开了他为之热诚服务几十年的祖国,流落他乡。他应英国剑桥大学的邀请,到鲍波实验室工作。4个月后,以色列的希夫研究所聘任哈伯前往做物理化学的研究工作。但是在去希夫研究所的途中,哈伯心脏病发作,于1934年1月29日在瑞士逝世。
结语
合成氨是一把双刃剑,它既可以让“空气变为面包”,造福人类,又可以制作炸药,给人类带来灾难。我们要正确看待和利用合成氨工艺!从合成氨工艺的发展远景来看,人类需要食物,食物需要氮素!粮食的刚需决定了合成氨的发展永远不会结束!
原文链接:https://mp.weixin.qq.com/s/WGpOBO8G3PdTFjZT0ybRug
